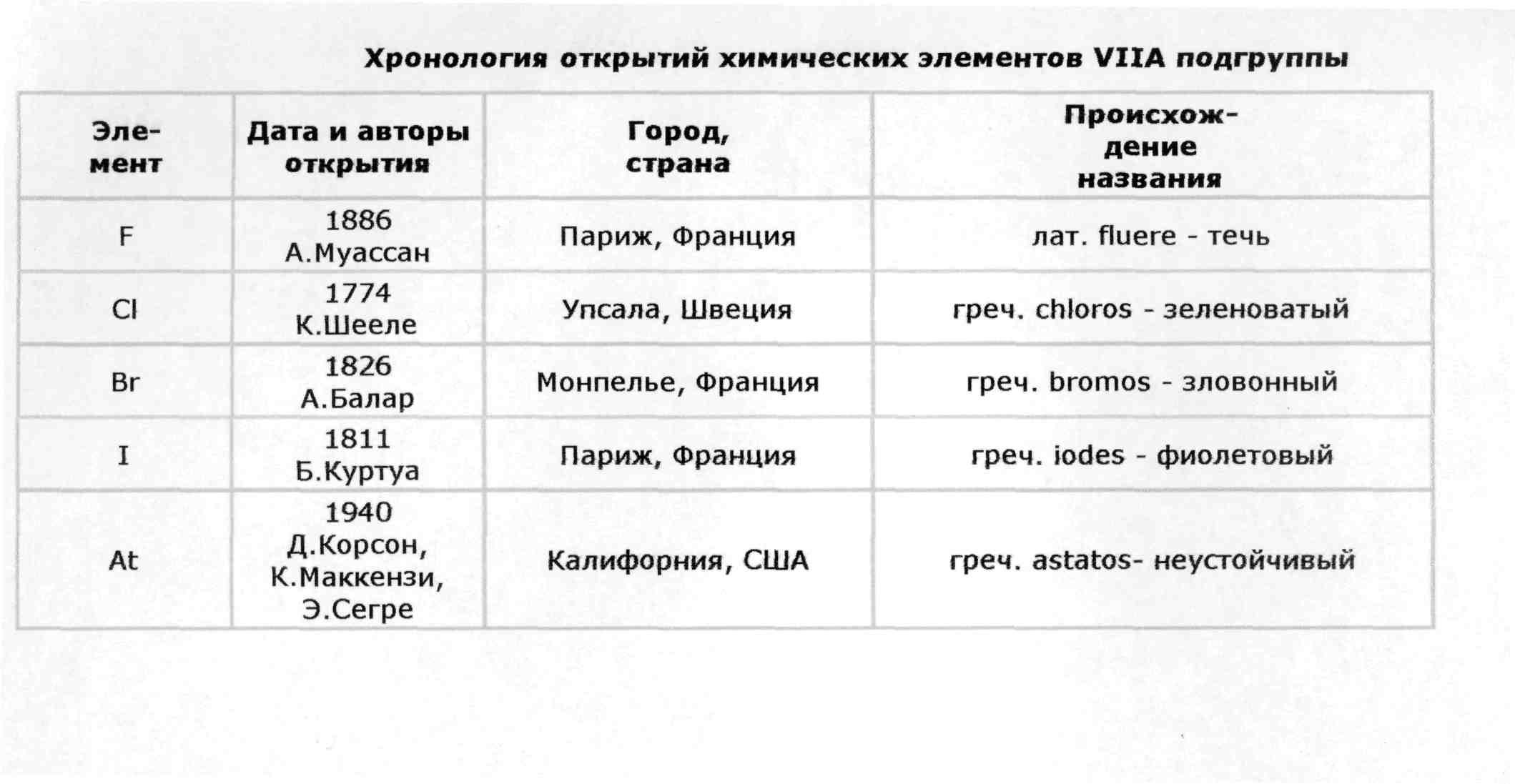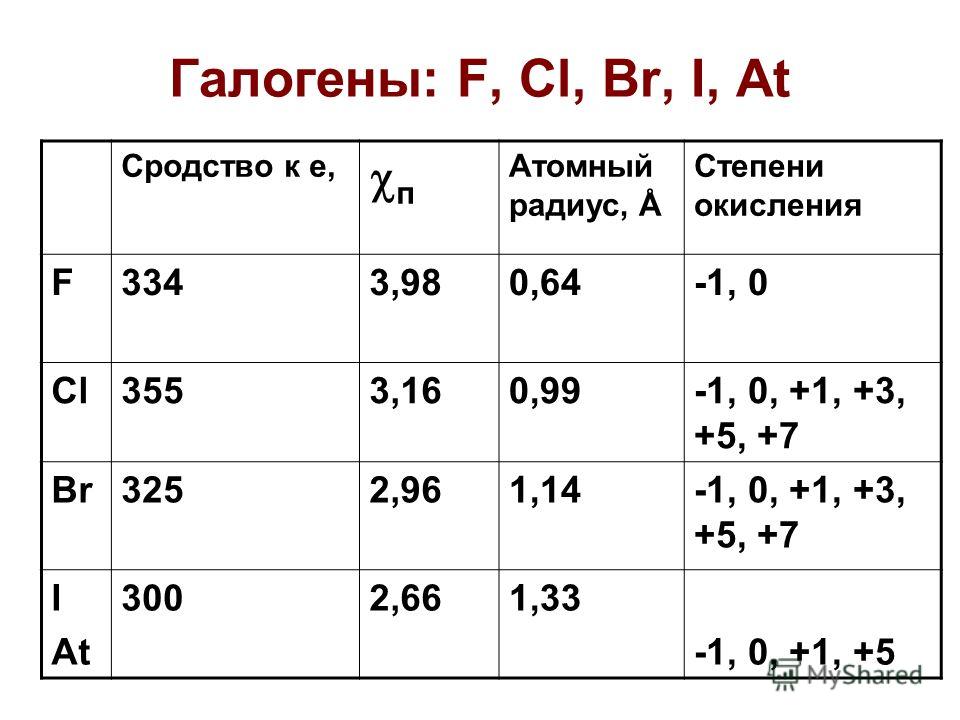
ОКСИДЫ ГАЛОГЕНОВ
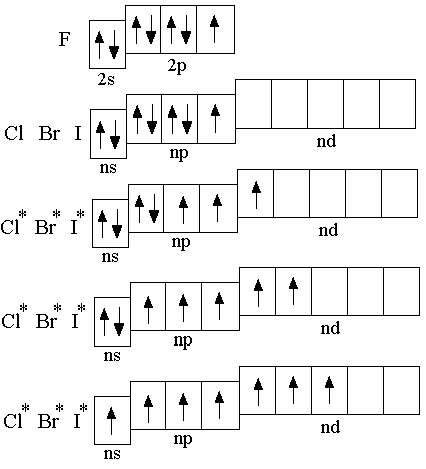
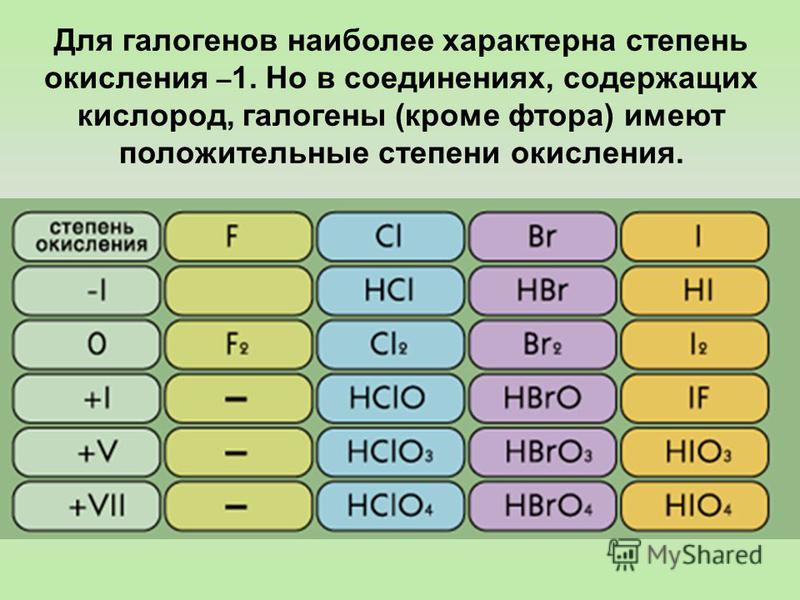
Менделеева по устаревшей классификации — элементы главной подгруппы VII группы [1]. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители , поэтому встречаются в природе только в виде соединений. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также формально искусственный элемент теннессин Ts. Все галогены — неметаллы , являются сильными окислителями. На внешнем энергетическом уровне 7 электронов.
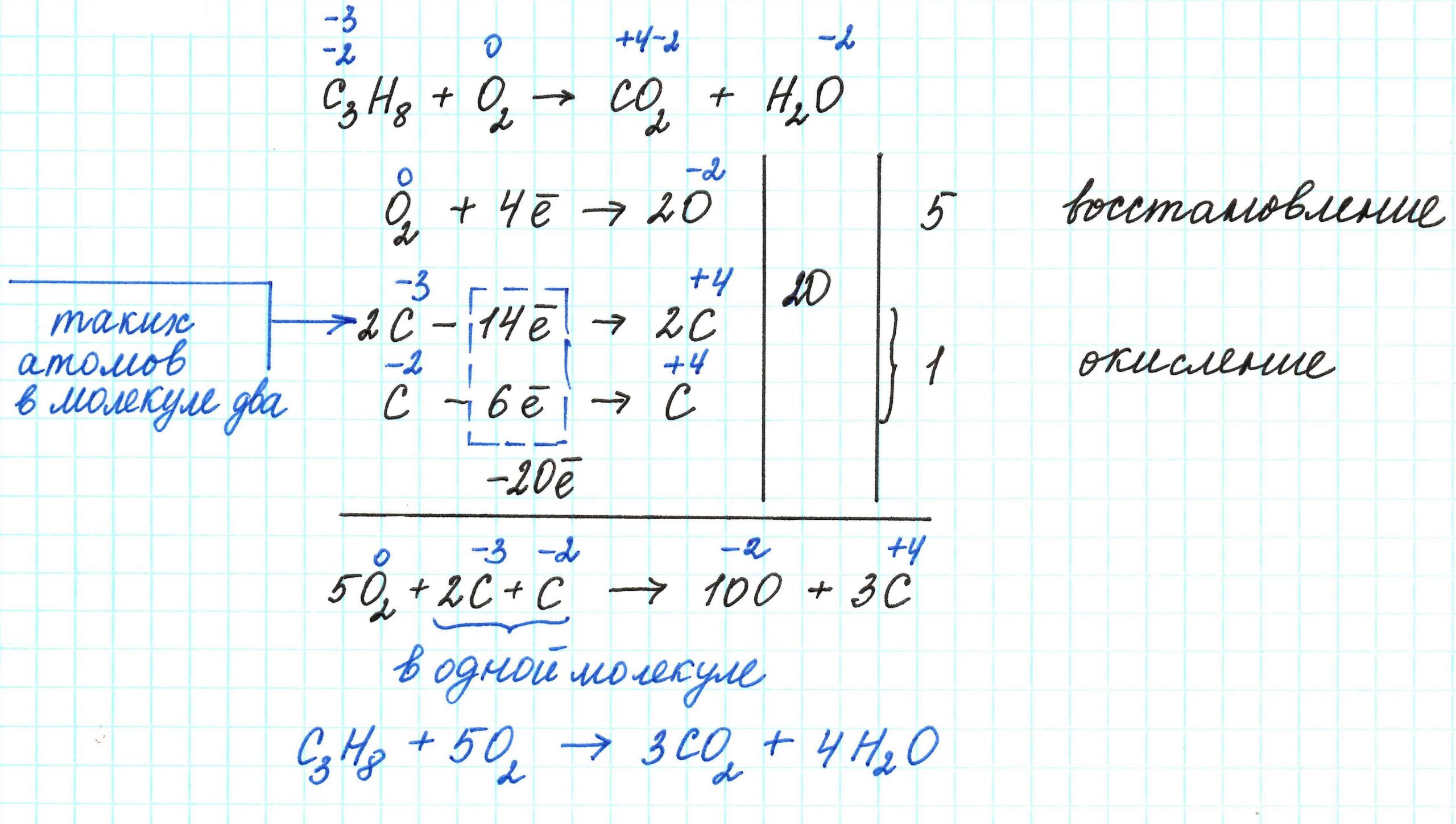


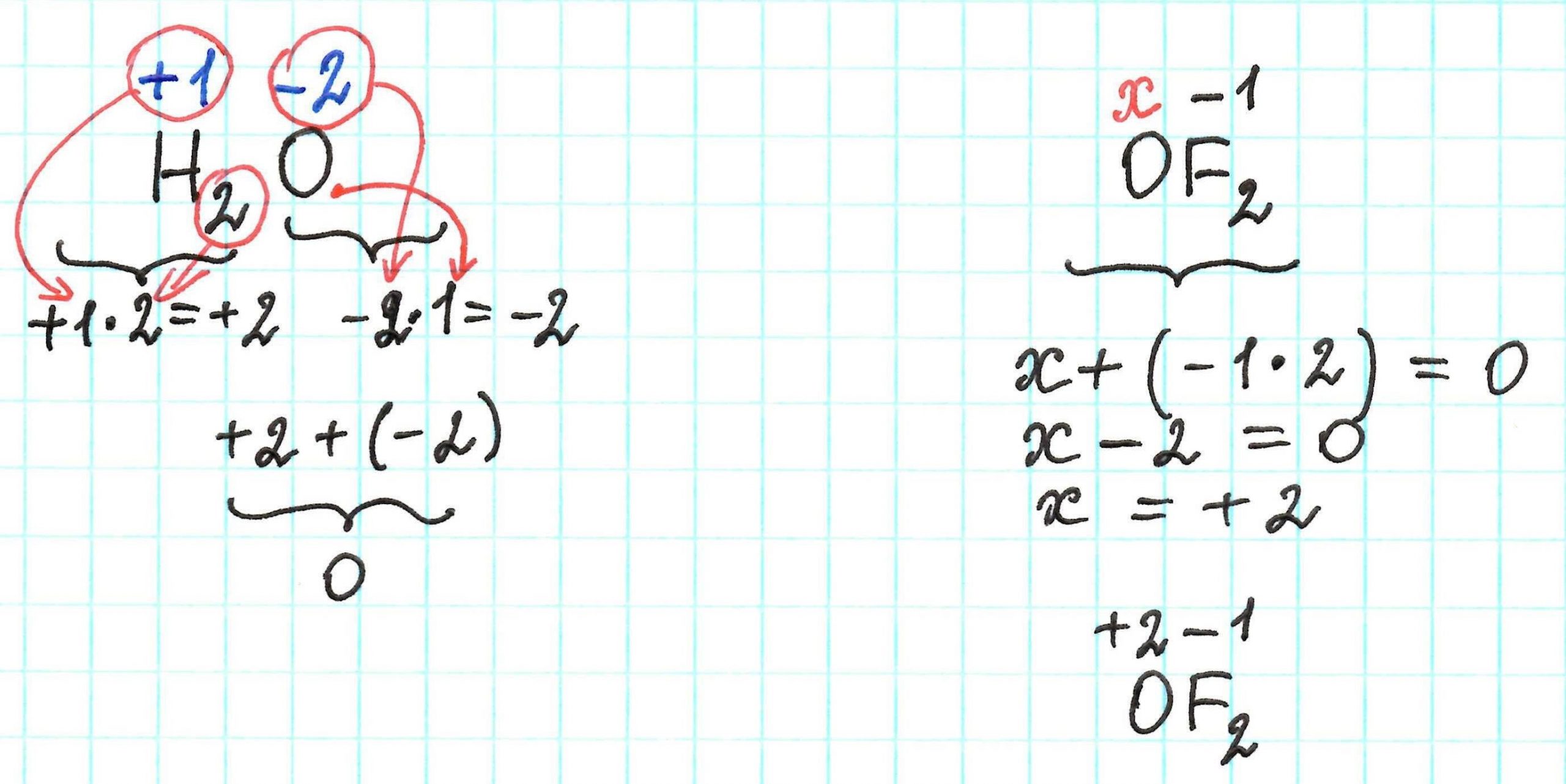


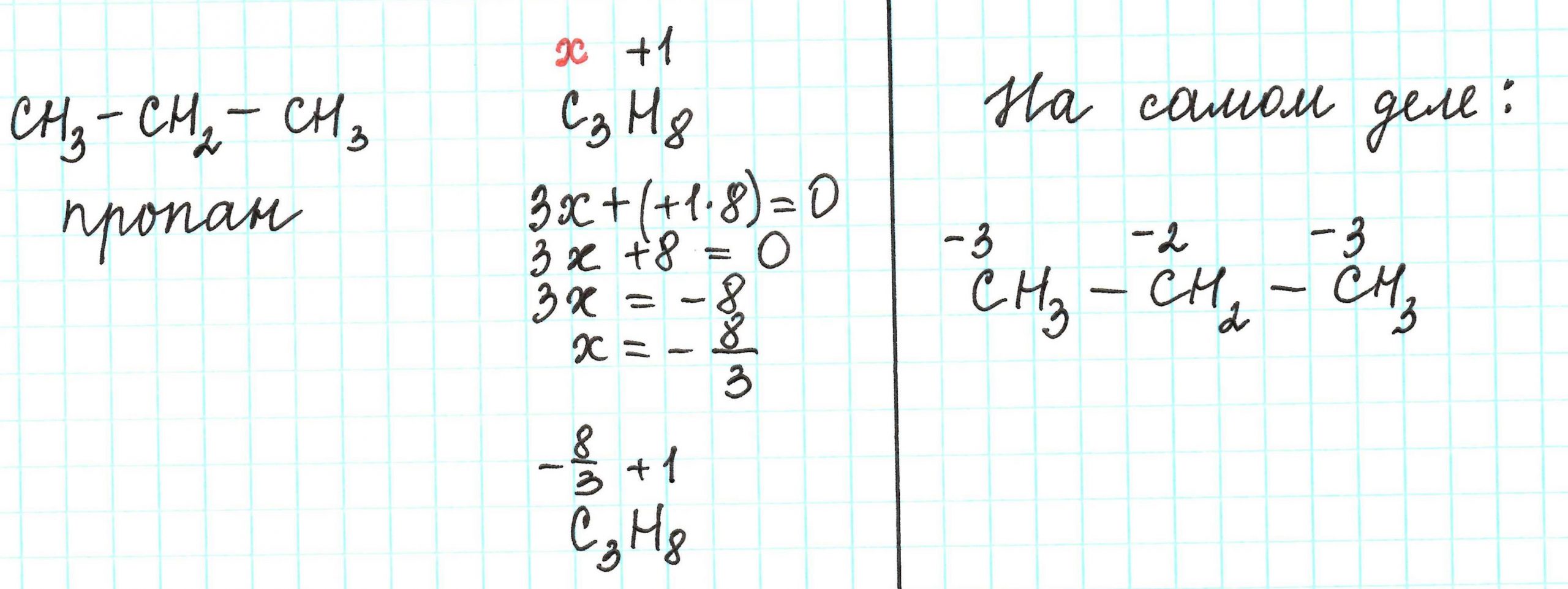


Окислительно - восстановительные реакции ОВР Реакции, протекающие с изменением степени окисления, называются окислительно — восстановительными. Степень окисления — условный заряд атома в соединении, вычисленный из предположения, что оно состоит только из ионов. В процессе реакции окислители восстанавливаются. В реакции восстановители окисляются.




Определите валентности атомов углерода и кислорода в соединении, электронная формула которого. Составьте его структурную и молекулярную формулы. По электронно-графической формуле составьте структурную, электронную и молекулярную формулы вещества.